Alois Alzheimer y la paciente Augusta D
La enfermedad de Alzheimer es unademencia que cuenta ya con más de 100 años de historia. En noviembre de 1901 ingresó en el hospital de enfermedades mentales de Frankfurt una paciente de 51 años de edad llamada Auguste Deter (Augusta D), con un llamativo cuadro clínico de 5 años de evolución.
Tras comenzar con un delirio celotípico, la paciente había sufrido una rápida y progresiva pérdida de memoria acompañada de alucinaciones, desorientación en tiempo y espacio,paranoia, trastornos de la conducta y un grave trastorno del lenguaje. Fue estudiada porAlois Alzheimer, y más tarde por parte de médicos anónimos. Falleció el 8 de abril de 1906 por una septicemia, secundaria a úlceras por presión y neumonía.
El cerebro de la enferma fué enviado a Alzheimer, que procedió a su estudio histológico. El 4 de noviembre de 1906 presentó su observación anatomoclínica con la descripción de placas seniles, ovillos neurofibrilares y cambios arterioescleróticos cerebrales.
El trabajo se publicó al año siguiente con el título: «Una enfermedad grave característica de la corteza cerebral». La denominación del cuadro clínico como enfermedad de Alzheimer fue introducida por Kraepelin en la octava edición de su «Manual de psiquiatría», en 1910.
Alzheimer describió su segundo caso en 1911, fecha en la que también aparece una revisión publicada por Fuller, con un total de 13 pacientes con enfermedad de Alzheimer, con una media de edad de 50 años y una duración media de la enfermedad de 7 años.
Las lesiones histopatológicas del cerebro de Augusta D han podido ser estudiadas de nuevo y publicadas en 1998 en la revista Neurogenetics. En este trabajo no se han encontrado lesiones microscópicas vasculares, existiendo solamente placas amiloideas y ovillos neurofibrilares, lesión ésta última descrita por primera vez por Alzheimer en este cerebro.
Etiología y epidemiología
La etiopatogenia de la enfermedad de Alzheimer es múltiple. Es hereditaria entre el 1% y el 5% de los casos (enfermedad de Alzheimer genética) por transmisión autosómica dominante de alteraciones en los cromosomas 1 (presenilina 2), 14 (presenilina 1) o 21 (Proteína Precursora de Amiloide, APP), con una edad de presentación generalmente anterior a los 65 años.
Factores genéticos en la enfermedad de Alzheimer
- Mutaciones que explican los casos de enfermedad de Alzheimer familiar de comienzo temprano (1-5 % de casos):
- Gen de la Proteína Precursora de Amiloide (APP; OMIM —herencia mendeliana humana en línea— *104760), cromosoma 21.
- Gen de la Presenilina 1 (PSEN1; OMIM *104311), cromosoma 14.
- Gen de la Presenilina 2 (PSEN2; OMIM *600759), cromosoma 1.
- Polimorfismos (variantes genéticas) que pueden incrementar la susceptibilidad de padecer enfermedad de Alzheimer esporádica (90-95% de todos los casos):
- Confirmados:
- Alelo ε4 del gen de la Apolipoproteína E (APOE), (cromosoma 19).
- No confirmados universalmente (resultados variables en los estudios de réplica):
- Gen de la α-2 macroglobulina.
- Gen del receptor de lipoproteínas de muy baja densidad (VLDL).
- Gen de la α-1 antiquimiotripsina.
- Gen de butirilcolinesterasa K.
- Gen de ubiquitina.
- Gen de la proteína τ.
- Genes mitocondriales (citocromo-oxidasas I y II).
- Genes de las interleucinas 1A y 1B.
- Otros, hasta unos setenta genes.
- Confirmados:
Cortesía de las doctoras Martínez García y Bullido Gómez-Heras,
Centro de Biología Molecular Severo Ochoa, Universidad Autónoma de Madrid.
En el resto de los casos (enfermedad de Alzheimer compleja o esporádica) la etiología es multifactorial con diversos factores de riesgo, que incluyen la predisposición genética (evidenciada porque aumenta la frecuencia si se tiene un pariente en primer grado con la enfermedad, y más aún si son varios), la edad (es más frecuente a partir de los 65 años, a partir de los cuales el riesgo se duplica cada 5 años) y factores de riesgo exógenos, ambientales, que parecen favorecer su desarrollo, como ocurre con los traumatismos craneoencefálicos graves.
En el alzhéimer esporádico, ni los factores genéticos ni los ambientales por separado provocan la enfermedad. Los factores genéticos y ambientales asociados entre sí son necesarios, pero no suficientes, precisando además del concurso del factor envejecimiento.
La enfermedad de Alzheimer es más frecuente en los sujetos portadores del alelo ε4 de la Apolipoproteína E (APOE, cromosoma 19), especialmente en los casos homocigóticospara dicho alelo. Por el contrario, se ha postulado un efecto opuesto para el alelo ε2 de la misma APOE, que tendría por tanto un papel protector.
Cada vez es más abrumadora la evidencia epidemiológica de que los factores de riesgo vascular (diabetes, hipertensión arterial, dislipemias, dietas ricas en grasas, tabaquismo…), y otros como la intoxicación crónica leve por metales como el cobre, favorecen también el desarrollo de la enfermedad de Alzheimer en las personas genéticamente predispuestas.
Muchos de esos factores son controlables mediante la dieta, el mantenimiento de un peso corporal adecuado y algunos medicamentos, lo que incrementa su importancia epidemiológica.
Lo mismo puede decirse de la llamada «Reserva Cognitiva». Los sujetos con mayor capacidad cognitiva natural y adquirida (cociente intelectual, cultura, estudios académicos, participación en actividades intelectuales y de esparcimiento como juegos de mesa, baile…) presentan la enfermedad más tarde que los sujetos con menor Reserva Cognitiva, a igual cantidad de lesiones histopatológicas cerebrales típicas de enfermedad de Alzheimer presentes en sus cerebros.
Dos personas pueden tener la misma cantidad de lesiones histopatológicas de enfermedad de Alzheimer, pero una de ellas puede mostrarse mucho más demenciada que la otra. La idea que hay detrás de la Reserva Cognitiva es que el cerebro intenta compensar activamente a la histopatología. Las personas pueden, por ejemplo, compensarse mejor mediante la utilización de redes cerebrales alternativas, o más eficientes, pudiendo funcionar con más normalidad pese a su histopatología.
También se ve afectada por la edad la prevalencia, que es de un 0,02% en el tramo de edad de 30 a 59 años, y pasa a ser de un 10,8% para el tramo comprendido entre los 80 y los 89 años.
Anatomía patológica e histología
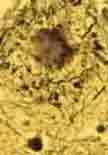
Placa Neurítica
En la enfermedad de Alzheimer se produce una atrofia cerebral progresiva, bilateral y difusa, que comienza en regiones mesiales temporales para afectar luego al neocórtex, sobre todo al temporal, parietal y frontal. Se producen la lesión y posterior destrucción de la neurona cerebral, en relación con la aparición tanto de depósitos insolubles extracelulares (placas amiloides, figura de la derecha) como intracelulares.
El elemento fundamental de los depósitos extracelulares es la proteína β-amiloide, que forma fibrillas y se agrega constituyendo las placas difusas y las placas neuríticas, estas últimas con núcleo denso y presencia de neuritas distróficas β-APP+ (proteína precursora de β-Amiloide inmunopositiva). El β-amiloide se produce por una escisión anómala de la APP (proteína precursora de amiloide). Cuando la APP es escindida por la α-secretasa, que es la vía normal, el producto resultante es un péptido soluble, eliminado después por el organismo con facilidad.
Pero en la enfermedad de Alzheimer predomina la escición consecutiva de la APP por parte de la β-secretasa primero, y de la γ-secretasa después, formándose entonces el péptido β-amiloide, insoluble, que las neuronas excretan a su exterior. A continuación, las células de la glía (astrocitos y microglía) intentan sin éxito la eliminación del β-amiloide, generándose un proceso inflamatorio que, junto con el propio efecto tóxico del β-amiloide, contribuye a lesionar a las neuronas.
En cuanto a los depósitos intracelulares, constituyen la degeneración neurofibrilar, cuyo principal componente es la proteína tau (τ). La proteína τ normal forma los "puentes" que mantienen correctamente unidos los microtúbulos que conforman el citoesqueleto neuronal, pero en la enfermedad de Alzheimer (en parte por la acción tóxica del β-amiloide) se produce una hiperfosforilación anómala de la proteína τ, desensamblándose el citoesqueleto y dando lugar a la degeneración neurofibrilar, con la formación de los ovillos neurofibrilares.
Los dos tipos de lesiones (placas neuríticas y ovillos neurofibrilares) se pueden encontrar también en el cerebro de ancianos sanos, y lo que en realidad marca el diagnóstico histopatológico es su cantidad y localización, correlacionándose su número y densidad con la intensidad de la demencia en estos pacientes.
Clínica
Los 10 signos de alarma de la enfermedad de Alzheimer que difunde la Alzheimer’s Association de los Estados Unidos y que recogemos bajo estas líneas, pueden ponernos en guardia al sugerirnos que una persona quizás esté iniciando esta enfermedad, de comienzo habitualmente insidioso.
El motivo de consulta suele ser la pérdida de memoria, especialmente de la memoria reciente. No recuerda el paciente dónde ha dejado las cosas (incluyendo objetos de valor), olvida citas, recados, se deja grifos abiertos y fuegos encendidos, y no recuerda a las personas que acaba de conocer, ni es capaz de aprender a manejar los nuevos electrodomésticos.
Los 10 signos de alarma de la enfermedad de Alzheimer
Reproducido de la Alzheimer’s Association
- Pérdida de memoria que afecta a la capacidad laboral.
- Dificultad para llevar a cabo tareas familiares.
- Problemas con el lenguaje.
- Desorientación en tiempo y lugar.
- Juicio pobre o disminuido.
- Problemas con el pensamiento abstracto.
- Cosas colocadas en lugares erróneos.
- Cambios en el humor o en el comportamiento.
- Cambios en la personalidad.
- Pérdida de iniciativa.
Repite una y otra vez las mismas cosas y hace una y otra vez las mismas preguntas, y tiene dificultades para encontrar la palabra adecuada en una conversación, utilizandoparafasias y circunloquios. El rendimiento laboral es cada vez más pobre, y comienza algo más adelante a presentar ideas delirantes, culpando a familiares de esconderle o quitarle las cosas.
Luego su aspecto comienza a dejar de preocuparle, y cada vez le cuesta más trabajo seguir una conversación, quedándose con frecuencia sin saber lo que iba a decir. Empieza ya a retraerse, tendiendo a dejar de salir y a abandonar sus aficiones habituales. Aparecen episodios de desorientación espacial, que inicialmente se refieren solo a los lugares menos familiares.
Su percepción de la realidad es cada vez más pobre, y el cuadro evoluciona ya con rapidez hacia la demencia grave. Tiene entonces dificultades para vestirse, asearse, manejar cubiertos de manera adecuada, duerme mal, está hiperactivo (pero sin finalidad determinada), y a veces se orina en la cama.
Pueden aparecer crisis epilépticas y mioclonías, y el paciente camina con lentitud, con el tronco flexionado. Orina y defeca en lugares inapropiados, apenas emite algunas palabras ininteligibles y tiene intensos trastornos del sueño y del comportamiento. Finalmente llega a no poder andar y a no comunicarse en absoluto, y fallece a causa de los procesos intercurrentes (úlceras por presión que se infectan, neumonías…).
La exploración ayudará a descartar otras enfermedades sistémicas y neurológicas, y a continuación hay que confirmar los déficits cognitivos recogidos en la anamnesis, y determinar su repercusión sobre la vida social y laboral del paciente. Se exploran la orientación, concentración, memoria, lenguaje, praxias, función ejecutiva…
Diagnóstico
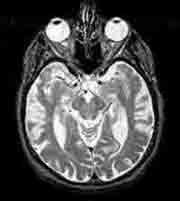
RNM: atrofia hipocámpica
Los criterios diagnósticos de demencia de tipo Alzheimer del DSM-IV-TR (Texto revisado de la cuarta edición del manual diagnóstico y estadístico de la Asociación Americana de Psiquiatría) o los criterios actualizados en 2011 de la demencia debida a enfermedad de Alzheimer probable del National Institute on Aging y la Alzheimer’s Association (NIA–AA, que sustituyen a los del NINCDS-ADRDA, National Institute of Neurologic, Communicative Disorders and Stroke - Alzheimer’s Disease and Related Disorders Association) deberían ser los utilizados de manera rutinaria para la enfermedad de Alzheimer.
Las siguientes pruebas complementarias deben realizarse de forma rutinaria:
Determinaciones en sangre y orina: glucosa, urea, creatinina, sodio, potasio, calcio, ácido úrico, colesterol, triglicéridos, aminotransferasas, gamma-glutamiltranspeptidasa (gamma-GT), fosfatasa alcalina y albúmina, además de pruebas de función tiroidea y niveles de vitamina B12. Hemograma completo. Serología de lúes sólo si el paciente tiene factores de riesgo específicos, aunque la Sociedad Española de Neurología recomienda su realización rutinaria. Análisis elemental de orina.
Pruebas de imagen: Tomografía Axial Computarizada (TAC) o Resonancia Nuclear Magnética (RNM) craneales.
Punción lumbar: solamente en caso de sospecha de infección del Sistema Nervioso Central (SNC), serología de lúes positiva, hidrocefalia, edad inferior a 55 años, demencia inusual o rápidamente progresiva, inmunosupresión, sospecha de vasculitis del SNC o presencia de enfermedad metastásica.
Electrocardiograma y radiología simple de tórax.
Electroencefalograma: sólo si existe historia de convulsiones, pérdida de consciencia, episodios de confusión o deterioro clínico rápido.
Las estrategias de medición linear o volumétrica mediante TAC o RNM no se recomiendan de manera rutinaria en la actualidad, ni la tomografía de emisión de positrones (PET). Tampoco la tomografía computarizada de emisión de fotón único (SPECT) cerebral se recomienda de manera rutinaria en el diagnóstico inicial o diferencial, ya que no ha demostrado superioridad sobre los criterios clínicos.
El estudio rutinario del genotipo APOE no se recomienda actualmente en los pacientes con sospecha de enfermedad de Alzheimer, ni tampoco el de otros marcadores genéticos. No hay marcadores del líquido cefalorraquídeo (LCR) ni otros marcadores biológicos recomendados para el uso rutinario en el diagnóstico de la enfermedad de Alzheimer en estos momentos.
Tratamiento
A. Tratamiento específico
Inhibidores de la colinesterasa: Se han demostrado efectos terapéuticos significativos con varios de ellos en la enfermedad de Alzheimer, indicando que son agentes mejores que el placebo de manera consistente. Sin embargo, la enfermedad sigue progresando a pesar del tratamiento, y la magnitud de la eficacia promedio es modesta (un retraso de entre 2 y 7 meses en el patrón progresivo de la evolución). Se han detectado con ellos cambios globales cognitivos, de comportamiento y funcionales.
Hasta ahora no se han llevado a cabo estudios comparativos cara a cara entre estos agentes, y las diferencias principales entre ellos están en los perfiles de efectos colaterales y en su sencillez de administración. Están autorizados para su uso clínico por la Food and Drug Administration (FDA) la tacrina, el donepezilo (o donepecilo), la rivastigmina y la galantamina (escritos aquí por orden de aparición en el mercado).
Memantina: Se trata de un antagonista no competitivo de los receptores NMDA (N-metil-D-aspartato), y actúa uniéndose en ellos al mismo lugar que fisiológicamente lo hace el magnesio, pero con mayor afinidad. Esto bloquea la entrada masiva de calcio que se produce en las células nerviosas cuando existe una excesiva actividad del glutamato que provoca el desplazamiento del magnesio.
La memantina ha sido aprobada ya para uso clínico por la Unión Europea y por la FDAde los Estados Unidos. La indicación aprobada actualmente de manera oficial es en los casos moderados, graves y moderadamente graves (estadios 5, 6 y 7 de la GDS -Global Deterioration Scale- de Reisberg), pero ya hay estudios en marcha para conseguir su aprobación para los casos leves. Asimismo, parece ser eficaz en la demencia vascular y podría tener efectos neuroprotectores, pero todo esto necesita aún de más estudios que lo corroboren.
Selegilina y vitamina E: Han demostrado eficacia en producir un cierto retraso en la evolución de la enfermedad tanto la vitamina E (a dosis de 1000 unidades internacionales (U.I.) dos veces al día) como la selegilina (a dosis de 5 mg dos veces al día), retrasando asimismo la institucionalización de los pacientes. No hay efecto aditivo entre ellos, no debiendo prescribirse simultáneamente. La vitamina E es mejor tolerada que la selegilina. Ninguno de estos dos agentes ha demostrado producir mejoras en el plano cognitivo.
Prednisona y estrógenos: Pese a que varios estudios epidemiológicos sugieren efectos protectores frente al desarrollo de enfermedad de Alzheimer por parte deesteroides y estrógenos, hasta ahora los ensayos clínicos llevados a cabo para corroborarlo han arrojado resultados negativos.
Antiinflamatorios no esteroideos: Un estudio prospectivo sobre 6989 personas de más de 55 años (de los que 293 desarrollaron enfermedad de Alzheimer durante un seguimiento de 6.8 años) ha demostrado una menor incidencia -estadísticamente significativa- de enfermedad de Alzheimer en los sujetos con un período de tratamiento acumulado de dos o más años con antiinflamatorios no esteroideos. Podrían tener eficacia en este sentido especialmente los antiinflamatorios no esteroideos con efecto inhibidor de la beta-secretasa.
Estatinas: Varios estudios epidemiológicos retrospectivos sugieren una menor incidencia (en torno a un 70% menos de media) de enfermedad de Alzheimer entre sujetos que estaban tomando estatinas como tratamiento para controlar su colesterol. De aquí podría deducirse también un efecto de la toma de estatinas sobre la progresión de la enfermedad de Alzheimer.
El mecanismo no está aún claro, aunque algunos estudios parecen indicar que las estatinas estimulan la vía de la α-secretasa para la escisión de la Proteína Precursora de Amiloide. Un estudio comunicado en la 54ª Reunión Anual de la A.A.N. (Academia Americana de Neurología) de abril de 2002, realizado sobre un total de 2581 sujetos, viene a corroborar una asociación estadísticamente significativa entre el tratamiento con estatinas y una menor incidencia de enfermedad de Alzheimer.
Ginkgo biloba: los datos sobre su posible eficacia son muy limitados, y en los pocos ensayos aleatorios que se han llevado a cabo la eficacia resulta ser menor que la típica obtenida con los anticolinesterásicos.
B. Tratamiento de los síntomas psicológicos y conductuales
Estos trastornos asociados a la enfermedad de Alzheimer (ansiedad, depresión, agitación, trastornos del sueño, etc.) obligan a valorar profundamente al paciente antes de prescribir ningún medicamento, pues muy frecuentemente son secundarios a causas orgánicas, desde un dolor cuya cualidad y localización no nos sabe describir el enfermo, hasta un simple estreñimiento. En estos casos, el tratamiento de la enfermedad causal resolvería también el trastorno psicológico o conductual.
Deberían utilizarse antipsicóticos para tratar la agitación o la psicosis en enfermos con demencia siempre que fallen los medios de manipulación del entorno. Los agentes atípicos (como la risperidona, la quetiapina o la olanzapina) pueden ser mejor tolerados en comparación con los agentes tradicionales como el haloperidol.
Sin embargo, en varios estudios se ha informado de una mayor incidencia de ictus y muerte entre los ancianos con edad muy avanzada y demencia tratados con algunos de estos agentes, que deberían ser utilizados a las dosis más bajas posibles y durante el mínimo tiempo necesario. En los pacientes con enfermedad de Alzheimer tratados con inhibidores de la colinesterasa parece demostrada una menor necesidad de antipsicóticos que en los no tratados.
En el tratamiento de la depresión en individuos con demencia puede considerarse el uso de antidepresivos como los inhibidores de recaptación de la serotonina (fluoxetina, citalopram, paroxetina…), mejor tolerados que la amitriptilina, que tiene efectoanticolinérgico. En cualquier caso el perfil de efectos colaterales guiará la elección del agente más idóneo para cada paciente. La trazodona, con ligero efecto sedante y sin efecto anticolinérgico alguno, puede ser muy útil, especialmente cuando a la depresión se asocian agitación e inquietud.
La ansiedad puede requerir el uso de ansiolíticos, siendo preferibles los de acción corta (como el alprazolam) a los de acción intermedia (como el bromazepam) o larga (como el diazepam). Deberemos esperar además al efecto de los anticolinesterásicos que se hayan podido empezar a administrar al paciente, pues es frecuente que ellos solos ya mejoren estos trastornos en estos pacientes. Los ansiolíticos se deben utilizar solamente durante cortos períodos de tiempo, y su retirada debe ser progresiva, especialmente con los de acción más prolongada.
Los trastornos del sueño pueden ser tratados con benzodiacepinas (como el lorazepam, el lormetazepam, el zolpidem o el triazolam), con clometiazol o bien con algúnneuroléptico (como la levomepromazina, que es una fenotiazina).
C. Tratamiento no farmacológico
Las medidas generales de tratamiento no farmacológico de las demencias son también de aplicación en la enfermedad de Alzheimer.
Enlaces externos de interés sobre la enfermedad de Alzheimer
- Alzheimer’s Association.
- Alzheimer’s Disease Education & Referral Center.
- Alzheimer Research Forum (Alzforum) .
- Alzheimer’s Society (Reino Unido).
- Alzheimer Europe.
- Alzheimer’s Disease International.
- Alzheimer Internacional.
- Alzhéimer: Instituto Nacional del Envejecimiento de los EEUU (en español).
- Portal Alzheimer-Online.
- Fundación Alzheimer España.
- Tu otro médico: enfermedad de Alzheimer.
- Revistaalzheimer.
- Asociación Alzheimer Argentina.
- Página de Alzheimer de Cristina Alba Benayas.
- Alzheimer web.
- Confederación Española de Asociaciones de Alzheimer.
- Medline Plus: Enfermedad de Alzheimer.
- Asociació Alzheimer de Catalunya.
- Medline Plus - enciclopedia médica: enfermedad de Alzheimer.
- Alzheimer en español.
- Asociación de Lucha contra el Mal de Alzheimer.
- Todo sobre el alzhéimer.
- Wikipedia: Alzheimer.
- Portal Mayores.
- Todoancianos.
- Alzheimer Society of Canada.
- Fed. Andaluza de Asociaciones de Familiares de Alzheimer.
- La etapa inicial en la enfermedad de Alzheimer.
- Alguien con Quien Contar.
0 comentarios